- Alder under 15 år og 40 år disponerer for mola (2,3)
- Tidligere mola graviditeter (2%)
- Disposition til mola i familien
- Geografi/genetik (Dobbelt så hyppigt blandt asiater)
- Fertilitetsbehandling er ikke en risikofaktor i sig selv (5). Omvendt ses 50% af tvillingegraviditeter med mola og normalt foster er forudgået af fertilitetsbehandling.(6)
- Væsentlig forhøjet hCG i forhold til normalområdet for gestationsalderen.
- Vaginal blødning (69-89%)
- Uterus større end forventet (28-33%)
- Hyperemesis (14-22%)
- Smerter / ovarie cyster
- Præeclampsi
- Hyperthyreose
- Asymptomatiske
- Blodprøver: Ved mistanke om mola tages P-hCG, Hgb, trombocytter, koag.status, levertal, væsketal og blodtype.
- Kirurgisk evacuatio ved bagvagt med sug nr 12 og stump curette. Bør kontrolleres med UL
- Forbehandling med prostaglandiner øger ikke risikoen for efterfølgende kemobehandling (11).
- Medicisnk abort er kontraindiceret
- Repræsentative dele af evacuatet fra en graviditet med klinisk mistanke om mola sendes til
- Patologiafdelingen til histologisk undersøgelse
- Ploidibestemmelse (ufikseret): Væv mhp evt. senere genetisk undersøgelse (ca ½ ml væv) lægges i et optøet vævsmedium fra fryseren på fødegangen (uden isklumper!). Prøven lægges i papkassen mærket MOLA i køleskabet over for stue 90 på afsnit 537 (som ikke er aflåst om aftenen/weekender).
- Bekræftes mola/partielmola ved histologien, sendes prøven til ploidibestemmelse på Kennedy Centret. På rekvisition anføres: Multiplex QF-PCR pga partiel/komplet mola.
Den læge der modtager mikroskopisvaret er ansvarlig herfor og anfører at væv er sendt på patologiseddelen. - Ploidibestemmelse anvendes som prædiktor for risiko for PTD (evidensgrad IIa)
- Triploid mola (40%) (udvikler "ikke" PTD)
- P-hCG ugentligt indtil 3 på hinanden følgende umålelige værdier. Derefter kan pt. afsluttes.
- Diploid mola (60%) eller mola uden sufficient ploidibestemmelse (Diploide udvikler PTD i 18%)
- P-hCG ugentligt indtil 2 umålelige værdier.
- Er P-hCG umålelig inden 8 uger --> månedligt p-hCG i 4 måneder, hvorefter pt kan afsluttes.
- Er P-hCG > 8 uger om at blive umålelig --> månedlig måling i 6 måneder efter hCG er blevet umålelig.
- Sikker antikonception bør anvendes i kontrolperioden (4a,4b og 4c). Gerne p-pillerog/eller kondom medens der er blødning og til 3 neg. P-hCG værdier. Herefter evt. IUD.
Bliver kvinden gravid før kontrolperioden er overstået, skal hun på basis af individuel vurdering (molatype, opnået kontrollængde) have målt s-hCG(fx 1 x månedligt) og tilbydes UL-scanning af placenta på Gyn Ul i uge 8.
Placenta skal efter fødslen sendes til histologi.
Hvis s-hCG har været < 3 IU/l før kvinden blev gravid igen, er chancen for et normalt graviditetsforløb yderst god. Har s-hCG ikke været <3 IU/l, skal det sikres at der ikke er tale om persisterende trofoblastvæv i stedet. - Persisterende trofoblast (PTD):
-
1. P-hCG stigende over 3 målinger (over 2 uger)
2. P-hCG-fald under 10% over fire målinger (over 3 uger)
3. P-hCG fortsat over nedre detektionsgrænse 6 mdr. efter evacuatio
- Ved gentagende mola og/eller familiært optrædende mola bør der henvises til genetisk udredning og rådgivning.
- Risiko for gentagelse af mola er 1:80 graviditeter.
- Kontrol ved fremtidige graviditeter (se også ovenfor: "Ny grav. f. afsluttet kontrol"):
- Tidlig UL (GA 7-8).
- Kontrol af P-hCG 8 uger efter endt graviditet.
Behandling af PTD:
Henvisning til Onkologisk afdeling.
Forudgået af røntgen thorax, UL af abdomen og bækken, GU og objektiv undersøgelse
Re-evac/hysteroskopi kan overvejes ved PTD, men kan ikke anbefales som standardbehandling idet remissionsraten er 10% (evidensgrad III) og der er øget risiko for perforation af uterus. - Ved tvillingegraviditet mola + et levende foster ses 1 per 20.000-100.000 graviditeter.
Graviditeten kan fortsættes med kontrol af P-hCG og UL, hvis der ikke tilkommer obstetriske komplikationer (blødning, præeklampsi, thyreotoxikose mv.). (Risiko for PTD = 20%, "Takehome rate" = 40%) - Ved tilfældigt fund af høj p-hCG bør pt. udredes for trofoblastsygdom. Eksempel på behandling af PTD
Dette dokument er flaget "Muligt forældet"
Find siden via vejledninger
Mola hydatidosa
2019
Indhold:
Baggrund Definition Genetik Risiko for mola Symptomer Behandling Kontrol "Falske hCG" Referencer Patientinformation ved Molagraviditet Mola hydatidosa har en speciel genetisk konstitution, idet den praktisk talt altid indeholder to sæt kromosomer fra faderen. I den vestlige verden forekommer den med en hyppighed på ca. 1 pr. 1.000 graviditeter, hvilket i DK sv.t. ca. 80 kvinder årligt. Mola kan udvikle sig til kemoterapikrævende persisterende trofoblastsygdom (PTD), invasiv mola, choriocarcinom og Placental Site Trophoblastic Tumor (PSTT). I DK behandles ca. 10 kvinder om året med kemoterapi efter en molagraviditet og overlevelsen er tæt på 100%. Hyppigheden af choriocarcinom er 1 pr. 20-40.000 graviditeter og PSTT er endnu sjældnere. En fjerdedel af choriocarcinomerne opstår efter en normal graviditet. Definition Trofoblastsygdomme er den samlede betegnelse for et spektrum af sygdomme karakteriseret af abnormt prolifererende trofoblast fra benign mola hydatidosa til maligne trofoblassygdomme (choriocarcinom og PSTT). Trofoblastsygdomme er karakteriserede ved at secernere hCG, og der er en tæt relation mellem hCG-koncentrationen i plasma og mængden af aktivt trofoblastvæv. PTD er alene en klinisk diagnose karakteriseret ved stagnerende eller stigende p-hCG værdier efter molagraviditet. Patoanatomi og genetik Patologerne afgør om der er tale om en mola - de inddeler den i en partiel eller komplet mola. Komplette mola er diploide og partielle er triploide. Ved patologisk verificeret mola bestemmes ploiditeten (antallet af kromosomsæt). Ploiditeten er vigtig da den anvendes som prædikter for risikoen for at udvikle PTD. Ca. 60% af mola er diploide, og ca. 40% er triploide. Af de diploide udvikler ca. 18% PTD, mens denne udvikling kun ses yderst sjældent hos de triploide (1). Sagt på en anden måde: Patienter med triploid mola kan følge et langt kortere kontrolprogram. Risikofaktorer for mola
Multiple lavekkogene blærer af vekslende størrelse i et ekkorigt tæt væv, der udfylder hele kaviteten. Ved partiel mola ses cystiske hulrum i placenta samt eventuelt væksthæmmet eller tilgrundegået foster.  Billeder venligst stillet til rådighed af Isa Niemann. Detektionsraten ved UL for komplet mola = 79% og for partiel mola = 29%, bedst efter 14. gestationsuge(7). Makroskopisk ses undertiden blærer á 1-10 mm ("drueklase graviditet") Høje P-hCG værdier P-hCG højere end ved en normal graviditet. Ved diploid mola (46 kromosomer) signifikant højere end ved triploid (69 kromosomer) mola; ved diploid mola er hyppigt > 100.000 IU/L (8,3) 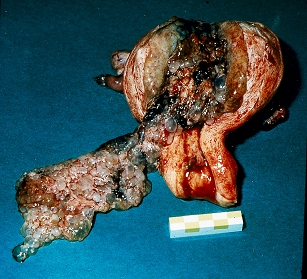 Foto Isa Niemann. Generelt bør væv fra en patologisk graviditet (unormal gestationssæk/foster, placenta patologisk eller væsentligt forhøjet hCG) altid sendes til histopatologisk undersøgelse (9,10).  (Sebire NJ. BMJ. 2008 Aug 15;337:a1193.): Falsk positiv hCG og quiescent mole (”tavs mola”) (ref. Herlev Gyn Obst afdeling 2019) Hos få patienter forbliver s-hCG let forhøjet (10-200 IU/l) i månedsvis. Her kan der enten være tale om falsk positive værdier, PTD eller quiescent mole. For at udelukke falsk positive hCG-værdier bør man kontrollere urin-hCG samt sende en blodprøve til et laboratorium med et andet hCG-assay. Der kan også foretages fortyndingsrække i laboratoriet for at udelukke, at s-hCG er falsk forhøjet. I sjældne tilfælde ses også kvinder, der fysiologisk secernerer en lille mængde hCG fra hypofysen, dette vil ophøre på behandling med p-piller. Forbliver s-hCG let forhøjede (uden stigning som tegn på PTD), er der tale om quiescent mole, og patienten henvises til onkologisk afdeling. Kvinder med quiescent mole skal følges længe - evt livslangt- da 10-25 % med tiden udvikler malign trofoblast sygdom og skal behandles med kemoterapi. Behandling oftest kun indiceret ved stigning i s-hCG. ICD10-koder Mola hydatidosa completa DO010 Mola hydatidosa incompleta et partialis DO011 Mola hydatidosa uden specifikation DO019 Referencer 1. Niemann I, Petersen LK, Hansen ES, Sunde L. Predictors of low risk of persistent trophoblastic disease in molar pregnancies. Obstet Gynecol 2006;107:1006-11. 2. Sebire NJ, Foskett M, Fisher RA, Rees H, Seckl M, Newlands E. Risk of partial and complete hydatidiform molar pregnancy in relation to maternal age. BJOG 2002;109:99-102. 3. Niemann I, Petersen LK, Hansen ES, Sunde L. Differences in current clinical features of diploid and triploid hydatidiform mole. BJOG 2007;114:1273-7. 4a. Berkowitz RS, Goldstein DP, Marean AR, Bernstein M. Oral contraceptives and postmolar trophoblastic disease. Obstet Gynecol 1981; 58:474. 4b. Curry SL, Schlaerth JB, Kohorn EI, et al. Hormonal contraception and trophoblastic sequelae after hydatidiform mole (a Gynecologic Oncology Group Study). Am J Obstet Gynecol 1989; 160:805. 4c. Palmer JR1, Driscoll SG, Rosenberg L, Berkowitz RS, et all. Oral contraceptive use and risk of gestational trophoblastic tumors. J Natl Cancer Inst. 1999 Apr 7;91(7):635-40. 5. Bates M, Everard J, Wall L, Horsman JM, Hancock BW. Is there a relationship between treatment for infertility and gestational trophoblastic disease? Hum Reprod. 2004 Feb;19(2):365-7. 6. Petignat P, Vassilakos P, Campana A. Are fertility drugs a risk factor for persistent trophoblastic tumour? Hum Reprod 2002;17:1610-15. 7. Fowler DJ, Lindsay I, Seckl MJ, Sebire NJ. Routine pre-evacuation ultrasound diagnosis fo hydatidiform mole: experience of more than 1000 cases from a regional referral center. Ultrasound Obstet Gynecol 2006;27:56-60. 8. Hancock BW, Tidy JA. Current management of molar pregnancy. J Reprod Med 2002;47:347-54. 9. Lindholm H, Flam F. The diagnosis of molar pregnancy by sonography and gross morphology. Acta Obstet Gynecol Scand. 1999 Jan;78(1):6-9. 10. Sebire NJ, Rees H, Paradinas F, Seckl M, Newlands E. The diagnostic implications of routine ultrasound examination in histologically confirmed early molar pregnancies. Ultrasound Obstet Gynecol. 2001 Dec;18(6):662-5. 11. Flam F, Lundström V, Pettersson F. Medical induction prior to surgical evacuation of hydatidiform mole: is there a greater risk of persistent trophoblastic disease? Eur J Obstet Gynecol Reprod Biol. 1991 Nov 3;42(1):57-60. Desuden er Hindsgavl Guidelines: Trofoblastsygdomme, anvendt ved udarbejdelsen. Sebire NJ, Seckl MJ. Gestational trophoblastic disease: current management of hydatidiform mole. BMJ. 2008 Aug 15;337:a1193.
|